percorso di Luca Vecchi
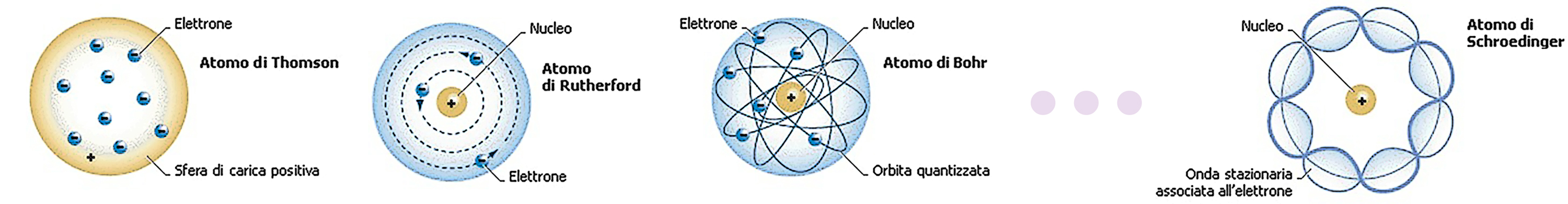
La versione classica dell'atomo di idrogeno è descritta da un modello in tutto e per tutto analogo a quello del pianeta nel potenziale gravitazionale di una stella. Un'implicazione di ciò che abbiamo visto nello studio del moto dei corpi celesti è che, in assenza di momento angolare, non esistono configurazioni di equilibrio non triviale (ovvero diverse da quella in cui l'elettrone si schianta sul protone e quella in cui entrambi sono fermi infinitamente distanti l'uno dall'altro). Perciò l'elettrone classico deve ruotare attorno al protone per rimanere in orbita. Ma Larmor ha mostrato che una carica accelerata irradia onde elettromagnetiche. Quindi nell'atomo classico l'elettrone perderebbe continuamente energia, ovvero diminuirebbe il proprio momento angolare, fino a collassare sul nucleo.

Nel mondo classico quest'ultima configurazione è sicuramente l'unica stabile (l'elettrone ha energia \(E=-\infty\)); ci aspettiamo che il sistema tenda naturalmente ad essa. Sfortunatamente, questa possibilità è completamente inconsistente con le osservazioni sperimentali. La stessa cosa avviene per i pianeti. La differenza è quantitativa: in quest'ultimo caso l'emissione di onde gravitazionali è cosi poco efficiente che il collasso richiede un tempo incredibilmente lungo.
Scopriamo che il momento angolare, essenziale per avere un'orbita classica, non può salvare il destino dell'atomo di idrogeno nel mondo reale. Allora perché l'idrogeno è stabile? La risposta corretta è che esiste una nuova costante della Natura \(\hbar\) che ha proprio l'unità di misura di un momento angolare. Nello studio dell'atomo di idrogeno non possiamo dimenticarci di questo ingrediente fondamentale. Con l'aggiunta di \(\hbar\), come mostrato nel riquadro, l'analisi dimensionale ci suggerisce che nell'atomo quantistico possa esistere una soluzione senza momento angolare! Capire quali siano le regole che determinano la dinamica di un elettrone nell'atomo di idrogeno ha comportato uno sforzo notevole da parte di tutta una classe di fisici brillantissimi di quel tempo. L'interpretazione del perché l'atomo di idrogeno è stabile viene dal principio di indeterminazione di Heisenberg, il quale impedisce all'elettrone di collassare sul nucleo: se potesse farlo ne avremmo determinato posizione e velocità in maniera troppo precisa per soddisfare \(\Delta (mv) \Delta x\geq \hbar/2\). Nella nostra deduzione invece né questo principio né lo stupefacente apparato matematico che si porta dietro è stato necessario! Senza conoscere le regole peculiari che ha introdotto Bohr per affrontare il problema, né il principio di Heisenberg, l'equazione di Schroedinger, ecc. l'analisi dimensionale ci ha portato al traguardo.

Niels Bohr fu il primo ad incorporare la costante di Planck nella fisica dell'atomo di idrogeno.
|
Dal punto di vista delle equazioni matematiche, le uniche differenze tra l'atomo di idrogeno classico e il moto del pianeta attorno ad una stella sono che \(m\) e \(m_*\gg m\) ora indicano la massa dell'elettrone e del protone, mentre il potenziale è \(U(r)=-\frac{\alpha}{r},\) con \(\alpha\) che identifica il quadrato della carica elettrica dell'elettrone (o del protone). Guardando la sezione precedente dedicata all'orbita dei pianeti, e ricordandosi che \(\hbar\) ha le unità di misura di un momento angolare (le stesse di J), ci accorgiamo che l'orbita e l'energia dello stato fondamentale (senza momento angolare) dell'atomo di idrogeno quantistico si possono scrivere come: \(r=a_6 \frac{\hbar^2}{\alpha m},~~~~~~~~~~E=a_7 \frac{\alpha^2m}{\hbar^2},\) dove ora entrambi \(a_6>0\) e \(a_7<0\) devono essere numeri puri. Queste sono proprio le espressioni ottenute da Bohr seguendo i suoi rivoluzionari postulati. Pochi anni dopo le corrette leggi che governano la fisica dell'infinitamente piccolo furono chiarite da Heisenberg e Schroedinger, i quali ci convinsero dei risultati che ora conosciamo: \(a_6=1\) e \(a_7=-1/2\). Una complicazione ulteriore di cui si deve tener conto in uno studio di precisione dell'atomo di idrogeno sono i possibili effetti relativistici. La velocità media dell'elettrone è ricavabile ancora una volta dall'analisi dimensionale e risulta essere \(\alpha/\hbar\), a meno di una costante che ci aspettiamo essere (ed in effetti è) vicina ad uno. Questa velocità deve essere piccola rispetto alla velocità della luce c se vogliamo essere autorizzati a trascurare la Relatività Ristretta. In altre parole, la variabile adimensionale dell'elettromagnetismo: \(\alpha_{\rm em}=\frac{\alpha}{\hbar c}\) deve soddisfare la condizione \(\alpha_{em}\ll1\) perché la nostra analisi dell'atomo di idrogeno abbia senso. L'inclusione degli effetti relativistici viene incorporata tramite la teoria di Dirac, dove \(a_6\), \(a_7\) diventano funzioni di \(\alpha_{em}\). Anche senza conoscere nel dettaglio questa teoria, grazie all'analisi dimensionale siamo in grado di capire che le correzioni rispetto ad una teoria non-relativistica come quella considerata qui sono controllate dal parametro \(\alpha_{em}\). Non ci stupiamo quindi che quest'ultima abbia acquisito un significato importante nella fisica, cosi importante da meritarsi un nome: costante di struttura fine. In effetti il suo valore numerico risulta essere piccolo in Natura, dell'ordine del percento, quindi le correzioni relativistiche che ne derivano sono piccole, o "fini". Se non fosse stato cosi, avremmo forse scoperto prima l'equazione di Dirac che la teoria di Bohr e l'equazione di Schroedinger?! Chissà.
|
L'analisi dimensionale ci permette di risolvere problemi che non sapremmo affrontare analiticamente. Mettendoci nei panni di uno scienziato all'epoca di Bohr, Heisenberg e Schroedinger abbiamo visto come avremmo potuto ricavare correttamente l'energia di legame e il raggio dell'atomo di idrogeno (e, nel riquadro, persino il parametro che governa le correzioni relativistiche!) senza sapere in pratica quali equazioni risolvere per ottenerli. Il genio dei fisici menzionati in questa ed altre sezioni si manifesta nella capacità di identificare le leggi che sottostanno a questi risultati. In questo processo l'analisi dimensionale può fare ben poco.