
Nella prima metà del XIX secolo, lo scienziato inglese George Gabriel Stokes  osservò che la fluorite Glossario, un minerale composto da fluoruro di calcio , emetteva una luce blu quando veniva illuminato con una luce ultravioletta . Le osservazioni di Stokes seguivano quelle eseguite nei precedenti venti anni da altri ricercatori trai i quali David Brewster e John Herschel. Nel 1833, il predicatore scozzese David Brewster aveva osservato che quando un raggio di luce attraversava una soluzione alcolica di clorofilla osservò che la fluorite Glossario, un minerale composto da fluoruro di calcio , emetteva una luce blu quando veniva illuminato con una luce ultravioletta . Le osservazioni di Stokes seguivano quelle eseguite nei precedenti venti anni da altri ricercatori trai i quali David Brewster e John Herschel. Nel 1833, il predicatore scozzese David Brewster aveva osservato che quando un raggio di luce attraversava una soluzione alcolica di clorofilla   , esso appariva di colore rosso sangue, in contrasto con il colore verde del corpo della soluzione. Successivamente nel 1845, Sir John Frederik William Herschel, figlio del più famoso William uno dei padri dell’astronomia moderna, osservò che una soluzione incolore di solfato di chinina sviluppava un colore superficiale blu quando esposta alla luce del sole. Gabriel Stokes descrisse ed interpretò questo fenomeno, a cui diede il nome di fluorescenza , esso appariva di colore rosso sangue, in contrasto con il colore verde del corpo della soluzione. Successivamente nel 1845, Sir John Frederik William Herschel, figlio del più famoso William uno dei padri dell’astronomia moderna, osservò che una soluzione incolore di solfato di chinina sviluppava un colore superficiale blu quando esposta alla luce del sole. Gabriel Stokes descrisse ed interpretò questo fenomeno, a cui diede il nome di fluorescenza  , in un suo famoso lavoro del 1852 “ On the Change of the Refrangibility of Light ”. Egli dimostrò che questo processo è dovuto all’emissione di luce conseguente al suo assorbimento da parte della sostanza in esame. , in un suo famoso lavoro del 1852 “ On the Change of the Refrangibility of Light ”. Egli dimostrò che questo processo è dovuto all’emissione di luce conseguente al suo assorbimento da parte della sostanza in esame.
Oggi sappiamo che la luminescenza  , fenomeno generale di cui la fluorescenza è un caso particolare, è l’emissione di luce che si origina dagli stati elettronici eccitati delle molecole. In particolare, quando una molecola assorbe un’opportuna quantità di energia, uno degli elettroni che occupa uno degli orbitali , fenomeno generale di cui la fluorescenza è un caso particolare, è l’emissione di luce che si origina dagli stati elettronici eccitati delle molecole. In particolare, quando una molecola assorbe un’opportuna quantità di energia, uno degli elettroni che occupa uno degli orbitali   [354] dello stato fondamentale può essere promosso in uno degli orbitali vuoti a maggiore energia. In questo modo si genera una specie non più in equilibrio che si trova in uno stato eccitato. Le molecole che si trovano nello stato eccitato tendono ad evolvere verso lo stato fondamentale di equilibrio dissipando l’energia accumulata in eccesso. Questo processo, detto di rilassamento, può avvenire in vari modi: ad esempio, disperdendo l’energia in eccesso attraverso l’aumento dei moti vibrazionali della molecola, trasferendo l’energia ad altre molecole; con la formazione o la rottura di legami chimici, oppure emettendo un fotone di luce. È proprio in ques’ultimo caso che si osserva appunto la luminescenza. [354] dello stato fondamentale può essere promosso in uno degli orbitali vuoti a maggiore energia. In questo modo si genera una specie non più in equilibrio che si trova in uno stato eccitato. Le molecole che si trovano nello stato eccitato tendono ad evolvere verso lo stato fondamentale di equilibrio dissipando l’energia accumulata in eccesso. Questo processo, detto di rilassamento, può avvenire in vari modi: ad esempio, disperdendo l’energia in eccesso attraverso l’aumento dei moti vibrazionali della molecola, trasferendo l’energia ad altre molecole; con la formazione o la rottura di legami chimici, oppure emettendo un fotone di luce. È proprio in ques’ultimo caso che si osserva appunto la luminescenza.
L’energia necessaria per generare uno stato eccitato può essere fornita alle molecole in vari modi. Quando l’emissione di luce viene stimolata dall’eccitazione per mezzo di una radiazione luminosa, come avviene per esempio nelle lampade fluorescenti  [358] , si definisce il fenomeno fotoluminescenza; nel caso in cui l’eccitazione ha luogo per mezzo di una corrente elettrica, come avviene per esempio nei diodi a emissione di luce a base organica (OLED) , allora si parla di elettroluminescenza; mentre se l’energia di eccitazione viene fornita per mezzo di una reazione chimica, come avviene per esempio in natura coi segnali luminosi generati dalle lucciole, si osserva la chemiluminescenza . [358] , si definisce il fenomeno fotoluminescenza; nel caso in cui l’eccitazione ha luogo per mezzo di una corrente elettrica, come avviene per esempio nei diodi a emissione di luce a base organica (OLED) , allora si parla di elettroluminescenza; mentre se l’energia di eccitazione viene fornita per mezzo di una reazione chimica, come avviene per esempio in natura coi segnali luminosi generati dalle lucciole, si osserva la chemiluminescenza .
Agli inizi degli anni ’60, Ed Chandross, ricercatore presso i Laboratori Bell di Murray Hill, NJ,  stava cercando un modo per produrre la chemiluminescenza, quando dopo parecchio lavoro trovò che una miscela di cloruro di assalile, acqua ossigenata ed un colorante fluorescente era in grado di generare luce con una efficienza dello 0.1%. Chandross, inconsapevole del potenziale della sua scoperta, non la brevettò mai. Nello stesso periodo Mike Rauhut, capo del settore ricerca dell’American Cyanamid Company a Stamford, CT, stava cercando un modo per produrre la chemiluminescenza, quando dopo parecchio lavoro trovò che una miscela di cloruro di assalile, acqua ossigenata ed un colorante fluorescente era in grado di generare luce con una efficienza dello 0.1%. Chandross, inconsapevole del potenziale della sua scoperta, non la brevettò mai. Nello stesso periodo Mike Rauhut, capo del settore ricerca dell’American Cyanamid Company a Stamford, CT,  , stava cercando di sviluppare una luce chimica sufficientemente intensa da avere applicazioni pratiche. Interessato ai risultati di Chandross, Rauhut con i suoi collaboratori alla Cyanamid preparò una serie di esteri ossalici , tra cui un estere fenil ossalico che miscelato con acqua osigenata ed un colorante era in grado di produrre luce con una efficienza del 5%. Verso la fine degli anni ’60, essi brevettarono il procedimento con il nome di Cyalume™, che divenne anche il marchio per la divisione dei prodotti chemiluminescenti dell’American Cyanamid Company. Successivamente, in seguito ad una riorganizzazione societaria, l’American Cyanamid Co. vendette la propria divisione di luce chimica ed i relativi brevetti e marchi registrati alla Omniglow di Springfield, MA, , stava cercando di sviluppare una luce chimica sufficientemente intensa da avere applicazioni pratiche. Interessato ai risultati di Chandross, Rauhut con i suoi collaboratori alla Cyanamid preparò una serie di esteri ossalici , tra cui un estere fenil ossalico che miscelato con acqua osigenata ed un colorante era in grado di produrre luce con una efficienza del 5%. Verso la fine degli anni ’60, essi brevettarono il procedimento con il nome di Cyalume™, che divenne anche il marchio per la divisione dei prodotti chemiluminescenti dell’American Cyanamid Company. Successivamente, in seguito ad una riorganizzazione societaria, l’American Cyanamid Co. vendette la propria divisione di luce chimica ed i relativi brevetti e marchi registrati alla Omniglow di Springfield, MA,  una fabbrica di prodotti chemiluminescenti, che tuttora continua lo sviluppo di nuovi prodotti per l’uso commerciale di luce chimica ed è detentrice legale del marchio Cyalume™. una fabbrica di prodotti chemiluminescenti, che tuttora continua lo sviluppo di nuovi prodotti per l’uso commerciale di luce chimica ed è detentrice legale del marchio Cyalume™.
 Le candele luminose (lightstick) sono costituite da almeno tre componenti: due reagenti chimici, che miscelati interagicono liberando energia, ed un colorante fluorescente che assorbe questa energia e la converte in luce. Più dettagliatamente, un estere dell’acido fenil-ossalico viene fatto reagire con acqua ossigenata (H2O2); l’ossidazione dell’estere dà luogo alla formazione di due molecole di fenolo ed una molecola dell’estere perossiacetico (C2O4). Quest’ultimo è una specie altamente instabile che si decompone spontaneamente in anidride carbonica (CO2) liberando energia che viene trasferita al colorante, il quale a sua volta la rilascia sotto forma di energia luminosa hn (vedi schema di reazione): Le candele luminose (lightstick) sono costituite da almeno tre componenti: due reagenti chimici, che miscelati interagicono liberando energia, ed un colorante fluorescente che assorbe questa energia e la converte in luce. Più dettagliatamente, un estere dell’acido fenil-ossalico viene fatto reagire con acqua ossigenata (H2O2); l’ossidazione dell’estere dà luogo alla formazione di due molecole di fenolo ed una molecola dell’estere perossiacetico (C2O4). Quest’ultimo è una specie altamente instabile che si decompone spontaneamente in anidride carbonica (CO2) liberando energia che viene trasferita al colorante, il quale a sua volta la rilascia sotto forma di energia luminosa hn (vedi schema di reazione):
estere fenilossalico + H2O2 → 2 fenolo + C2O4
C2O4 + colorante → 2 CO2 + colorante*
colorante* → colorante + hn
La sostanza asteriscata (colorante*) indica una molecola che si trova in uno stato eccitato, cioè in uno stato non di equilibrio ad una energia superiore rispetto a quella dello stato fondamentale di equilibrio al quale ritorna emettendo energia in tempi caratteristici della sua vita media Glossario .
In pratica l’estere utilizzato è il bis (2-carbopentiloxi-3,5,6-triclorofenil) ossalato (CPPO) disciolto in bis(etilxilil)ftalato in presenza di un catalizzatore, per esempio salicilato di sodio (un parente dell’aspirina). In questa soluzione, contenuta all’interno di un tubo di plastico (la candela luminosa), viene disciolto anche il colorante responsabile dell’emissione luminosa. L’altro reagente, cioè l’acqua ossigenata (H2O2), è racchiuso all’interno di una fiala di vetro che viene rotta piegando il tubo, consentendo così ai reagenti di venire a contatto e di dare inizio alla reazione. Per ottenere la luce di diversi colori si utilizzano diversi coloranti, singolarmente o in combinazione tra loro.
| COLORE |
COLORANTE |
| Blu |
9,10-difenil antracene |
| Verde |
9,10-bis(feniletinil) antracene |
| Giallo |
1-cloro-9,10-bis(feniletinil) antracene
5,6,11,12-tetrafenil naftacene
|
| Arancio |
5,12-bis(feniletinil) naftacene Rodamina 6G |
| Rosso |
Rodamina B |
Nella tabella sono elencati alcuni dei coloranti più diffusi utilizzati per generare la luce dei rispettivi colori.
In particolare, nonostante sia possibile ottenere la luce rossa direttamente utilizzando un colorante (Rodamina B) , questo colorante non è molto stabile in soluzione con l’estere fenilossalico. Allora si preferisce inglobare nella plastica dell’involucro un pigmento rosso che assorbe la luce, in genere gialla, generata all’interno della candela e la riconverte in luce rossa. I colori più difficili da ottenere sono il blu, per l’alta energia di eccitazione necessaria, ed il rosso, per i motivi di stabilità del colorante già esposti, mentre il giallo ed il verde sono i più semplici.
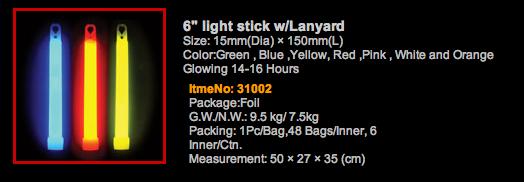
Il maggiore produttore mondiale di candele di luce è la Cina. Nel catalogo della Beijing Wenhaiyang Industry&Trading Co., Ltd sono presenti candele di luce azzurre, gialle, rosse, rosa, bianche ed anche arancio ma mancano quelle viola. Il fatturato mondiale relativo alle candele di luce è cresciuto moltissimo negli ultimi decenni. Le applicazioni delle candele di luce sono oggi molto numerose: attività militari, sicurezza, segnalazioni notturne, outdoor, caccia, pesca, campeggio, immersioni, festeggiamenti e mille altre ancora .
Mentre i colori precedenti possono essere ottenuti utilizzando un singolo colorante, per il viola invece è necessario utilizzare una miscela di tre coloranti e per la complessità della formulazione rappresenta l’incubo di tutti i produttori di candele luminose!!
Andrea Barbieri - Chimico
Nota Redazionale SxT
(bibliografia,webgrafia: cyalume – SxT_ es_377)
Joseph R. Lakowicz (1999). Principle of Fluorescence Spectroscopy, 2nd ed. New York, Kluwer Academy / Plenum Publishers.
Elizabeth Wilson. Light Sticks. Chemical & Engineering News 1999, 77, 65. Michael M. Rauhut;
Laszlo J. Bollyky. Generation of light by the reaction of anhydrides of oxalic acid with a peroxide in the presence of a fluorescer Patent nr. CA814907,1969-06-10
About Chemistry http://chemistry.about.com
HowStuffWork http://science.howstuffworks.com/light-stick.htm
|
