|
|
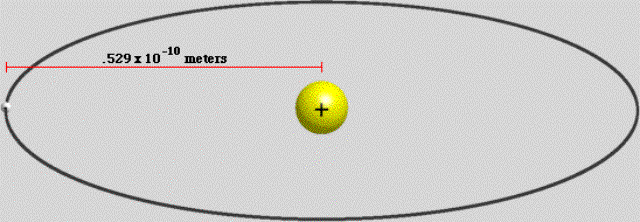
Ho letto su un libro divulgativo che per trovare il valore del raggio dell’elettrone intorno al nucleo (o raggio di Bohr), si usa la seguente formula: \[r=\frac{(h/2\pi)^2}{(me^2)n^2}\] dove : h/2π è h tagliata di valore 1,055.... m = massa dell’elettrone di valore 9,11..... e = carica dell’elettrone 8,199.... n = numero quantico che può essere 1,2,3,4,5,6,7 (per semplicità si può assumere il valore 1) Il risultato di questa formula dovrebbe essere un raggio di 53 Angstrom. Ora io per curiosità ho provato a fare il calcolo, ma o commetto un errore matematico oppure i valori che uso non sono esatti, perché quel valore di 53 non mi viene......Mi potreste aiutare ? (Antonella Capuano) |
Per quanto riguarda la formula relativa al "raggio di Bohr \[r=\frac{(h/2\pi)^2}{(me^2)n^2}\] dove: \(\hbar\) è la costante di Planck-tagliata = 1.055 × 10-34 [Joule X secondi] m: è la massa dell'elettrone = 9.109 × 10-31 [chilogrammi] k0: è la costante di Coulomb = 8.988 × 109 [Joule X metri / Coulomb2], meglio conosciuta come \(1/(4\pi \epsilon)\) e dove \(\epsilon \) è la costante dielettrica e: è la carica dell'elettrone = 1.602× 10-19 [Coulomb] Dall'analisi dimensionale viene ora fuori che: \[metri~=~\frac{Joule^2 ~\cdot ~secondi^2}{Chilogrammi ~\cdot ~\frac{Joule ~\cdot ~ metri}{Coulomb^2}\cdot ~ Coulomb^2}\] considerando che, dimensionalmente, \[Chilogrammi ~ = ~ \frac{Joule ~\cdot ~ secondi^2}{metri^2}\] tutto torna come volevamo! Come avrai notato le dimensioni che stiamo usando sono i metri. I metri sono considerati, convenzionalmente, come la dimensione fondamentale nel Sistema metrico Internazionale per esprimere una lunghezza. E’ importante anche ricordare però che, storicamente, esistono dimensioni espresse in Angstrom La costante dielettrica ? non è un oggetto misterioso, ma è collegato alla quantità di carica elettrica che un mezzo (incluso il vuoto) può contenere e compare nella famosa formula di Coulomb
La formula di Bohr costituisce uno dei primi tentativi di unione della fisica classica con la quantistica. Il problema che assillava Bohr era il perché l'elettrone non collassasse sul nucleo. L'idea fu di considerare un elettrone come un'onda (meccanica quantistica) e ipotizzare che nel descrivere l'intera circonferenza, l'elettrone dovesse tornare al punto di partenza. In pratica la circonferenza doveva essere un multiplo della lunghezza d'onda dell'elettrone. Proprio tale lunghezza d'onda era legata, dalla formula di de Broglie, all'energia della particella e alla costante di Planck
Classicamente, un corpo di massa "m", con carica "e", in moto su una circonferenza di raggio "r", con velocità "v", sente una forza centripeta \[f(r)=m\frac{v^2}{r}\] al contrario, l'attrazione elettrostatica genererà una forza \[F(r)=k_0 \frac{e^2}{r^2}\] tali due forze devono compensarsi affinché il corpo non sfugga o non collassi, quindi f(r)=F(r). A questo punto interviene la formula di Planck che ci dice che \[rmv=\hbar\] Con un pò di semplice algebra si può scrivere \[m\frac{v^2}{r}=k_0\frac{e^2}{r^2}\] sostituendo \[\frac{\hbar^2}{mr^3}=k_0\frac{e^2}{r^2}\] e quindi si ottiene la formula del raggio di Bohr \[r=\frac{\hbar^2}{k_0me^2}\] Pasquale Di Nezza – Fisico |
||
|
|
||