 Il percorso “Le origini della Fisica delle Particelle” racconta gli esperimenti fondamentali che hanno portato dalla scoperta del nucleo atomico, a quella dei costituenti nucleari, quali protoni e neutroni, fino alla scoperta dei mattoncini fondamentali del nucleo atomico, ovvero i QUARKS. Tutte queste scoperte hanno dato origine alla nascita del MODELLO STANDARD della fisica delle particelle. E se ci fosse qualcosa di più piccolo dei quarks? Alla fine del percorso viene presentata brevemente anche questa nuova frontiera della fisica, con una breve introduzione alla teoria delle stringhe.
Il percorso “Le origini della Fisica delle Particelle” racconta gli esperimenti fondamentali che hanno portato dalla scoperta del nucleo atomico, a quella dei costituenti nucleari, quali protoni e neutroni, fino alla scoperta dei mattoncini fondamentali del nucleo atomico, ovvero i QUARKS. Tutte queste scoperte hanno dato origine alla nascita del MODELLO STANDARD della fisica delle particelle. E se ci fosse qualcosa di più piccolo dei quarks? Alla fine del percorso viene presentata brevemente anche questa nuova frontiera della fisica, con una breve introduzione alla teoria delle stringhe.
Come i nostri lettori probabilmente già sanno, i nucleoni, costituenti dei nuclei atomici, sono il protone ![]() (simbolo p, massa
(simbolo p, massa ![]() 1.6726x10-27 kg, carica elettrica +1.6026x10-19 Coulomb - opposta a quella dell'elettrone
1.6726x10-27 kg, carica elettrica +1.6026x10-19 Coulomb - opposta a quella dell'elettrone ![]() ) ed il neutrone
) ed il neutrone ![]() (simbolo n, massa 1.6750x10-27 kg, carica elettrica nulla). Fino al 1914, le informazioni sperimentali sulla struttura degli atomi, dovute soprattutto ad Ernest Rutherford
(simbolo n, massa 1.6750x10-27 kg, carica elettrica nulla). Fino al 1914, le informazioni sperimentali sulla struttura degli atomi, dovute soprattutto ad Ernest Rutherford ![]() (1871-1937) ed ai suoi collaboratori, erano arrivate fino al punto di poter affermare che tutti gli atomi sottoposti ad investigazione erano costituiti da un piccolo nucleo, nel quale era concentrata tutta la massa dell’atomo, carico positivamente e molto piccolo (raggio circa 10-15m): attorno al nucleo, ad una distanza dell'ordine di circa 10-10m, erano 'posizionati' o 'orbitanti' gli elettroni.
(1871-1937) ed ai suoi collaboratori, erano arrivate fino al punto di poter affermare che tutti gli atomi sottoposti ad investigazione erano costituiti da un piccolo nucleo, nel quale era concentrata tutta la massa dell’atomo, carico positivamente e molto piccolo (raggio circa 10-15m): attorno al nucleo, ad una distanza dell'ordine di circa 10-10m, erano 'posizionati' o 'orbitanti' gli elettroni.
Le specie atomiche sottoposte ad investigazione erano state, negli anni immediatamente precedenti alla prima guerra mondiale, soprattutto lamine di metalli (Oro, ...).
Durante la guerra Rutherford, (nato in Nuova Zelanda, ma britannico a tutti gli effetti - si era trasferito in Inghilterra da tempo e, comunque, la Nuova Zelanda è diventata indipendente nel 1931) aveva dedicato tutto il suo tempo nelle ricerche belliche per l'individuazione dei sottomarini tedeschi.
Nel 1918 poté riprendere il suo lavoro per continuare lo studio sistematico della misura dei raggi nucleari di varie specie atomiche.
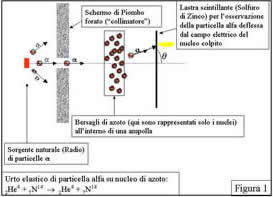
Un tipico esperimento, figura 1, consisteva nell'utilizzare delle particelle alfa (nuclei di Elio, che oggi sappiamo essere composto da due protoni e da due neutroni) prodotte da una sorgente radioattiva ![]() naturale che venivano fatte incidere sul materiale da esaminare: in questo caso si trattava di azoto (che oggi sappiamo essere composto da 7 protoni e 7 neutroni).
naturale che venivano fatte incidere sul materiale da esaminare: in questo caso si trattava di azoto (che oggi sappiamo essere composto da 7 protoni e 7 neutroni).
Le particelle alfa, cariche positivamente, subiscono una repulsione elettrostatica da parte del nucleo (anch'esso carico positivamente): la misura dell'angolo di deflessione (q in figura) viene effettuata per molte collisioni di particelle alfa in successione e la serie delle osservazioni permette di ottenere le informazioni sui nuclei del materiale indagato.
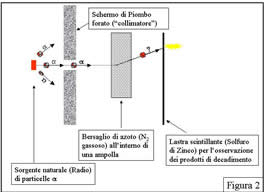
Ma, proprio dall'osservazione dell'azoto, è arrivata la sorpresa: il segnale di scintillazione ![]() osservato non era tipico del segnale delle particelle alfa, e nemmeno del segnale che si ottiene da un nucleo di azoto (figura 2).
osservato non era tipico del segnale delle particelle alfa, e nemmeno del segnale che si ottiene da un nucleo di azoto (figura 2).
Era piuttosto il segnale che si otterrebbe facendo urtare una particella alfa su idrogeno ed osservando il nucleo di idrogeno rinculare fino al rivelatore! Rutherrford concluse - tutti gli esperimenti successivi lo hanno confermato - che nel nucleo di azoto erano presenti nuclei di idrogeno e che era stata prodotta la reazione: He + N --> H + O (figura 3).
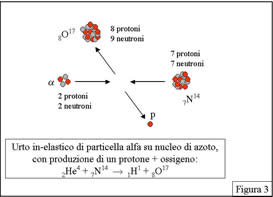
In altri termini, sono emerse due scoperte fondamentali: la prima che uno dei costituenti dei nuclei atomici è il nucleo di idrogeno (da allora chiamato "protone"), la seconda che ai fisici era riuscito quello che gli alchimisti avevano tentato per secoli, cioè la trasformazione di una specie chimica in un'altra.
Le misure avevano poi mostrato che la massa di ogni nucleo era, con buona approssimazione, un multiplo intero della massa del protone.
A titolo di esempio, il nucleo di Elio ha una massa pari a 4 volte la massa del protone.
Poiché la massa dell'elettrone è trascurabile (circa 1/2000) rispetto alla massa del protone, Rutherford nel 1920 avanzò l'ipotesi - che poi si rivelò non vera - che ogni nucleo atomico potesse essere composto da A (numero atomico ![]() ) protoni e da (A-Z) elettroni. In questo schema, il nucleo di Elio sarebbe composto da 4 protoni e 2 elettroni (oggi, ripeto, sappiamo che è composto da due protoni e due neutroni). Ma accanto a questa ipotesi, Rutherford ipotizzò anche che, all'interno del nucleo, un protone ed un elettrone potessero essere legati intimamamente formando un oggetto neutro: il "neutrone". Si aprì pertanto la caccia a questo nuovo costituente della materia.
) protoni e da (A-Z) elettroni. In questo schema, il nucleo di Elio sarebbe composto da 4 protoni e 2 elettroni (oggi, ripeto, sappiamo che è composto da due protoni e due neutroni). Ma accanto a questa ipotesi, Rutherford ipotizzò anche che, all'interno del nucleo, un protone ed un elettrone potessero essere legati intimamamente formando un oggetto neutro: il "neutrone". Si aprì pertanto la caccia a questo nuovo costituente della materia.