Vorrei sapere con quale velocità un elettrone gira attorno al nucleo. L’atomo di idrogeno che per esempio ha un solo elettrone e quindi c'è una sola orbita. Quale è la velocità dell'elettrone? Ci sono poi atomi che hanno più elettroni e più orbite e per ogni orbita c'è una velocità diversa. Quali sono queste velocità? Ed eventualmente qual'è la formula per calcolarle ? (Dario)
![]() L'atomo dell’idrogeno ha un numero infinito di livelli energetici (stati stazionari discreti) possibili per l'elettrone. A questa evidenza conducono una serie di osservazioni sperimentali ed essa può essere ottenuta come conseguenza dei postulati della teoria della meccanica quantistica. Secondo il ragionamento di Niels Bohr (1913) , l'atomo, a differenza dei sistemi di meccanica classica, non può assorbire energia in quantità piccole a piacere, ma può esistere solo in determinati stati con valori distinti dell'energia E < E ' < E '',... Un atomo può cambiare stato emettendo (rispettivamente assorbendo) una radiazione con energia pari al valore assoluto della differenza di energia degli stati stazionari iniziale e finale, portandosi nel contempo nello stato stazionario finale, che ha un'energia inferiore (rispettivamente superiore) a quello di partenza.
L'atomo dell’idrogeno ha un numero infinito di livelli energetici (stati stazionari discreti) possibili per l'elettrone. A questa evidenza conducono una serie di osservazioni sperimentali ed essa può essere ottenuta come conseguenza dei postulati della teoria della meccanica quantistica. Secondo il ragionamento di Niels Bohr (1913) , l'atomo, a differenza dei sistemi di meccanica classica, non può assorbire energia in quantità piccole a piacere, ma può esistere solo in determinati stati con valori distinti dell'energia E < E ' < E '',... Un atomo può cambiare stato emettendo (rispettivamente assorbendo) una radiazione con energia pari al valore assoluto della differenza di energia degli stati stazionari iniziale e finale, portandosi nel contempo nello stato stazionario finale, che ha un'energia inferiore (rispettivamente superiore) a quello di partenza.
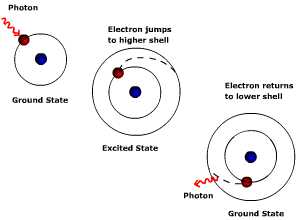
Sono raffigurati i processi di assorbimento e emissione in un atomo
L'immagine dell'elettrone rotante attorno al nucleo, tipica della meccanica classica, non può rendere ragione dello spettro di emissione dell'atomo: ciò è reso possibile dall'ipotesi sopra citata che l'atomo possieda solo determinati livelli energetici (spettro). Se si impone alla teoria quantistica dell'atomo di ridursi alla meccanica classica nel limite di masse e dimensioni delle orbite grandi (principio di corrispondenza di Bohr, 1923) allora è possibile associare ad ogni livello energetico dell'atomo concetti di tipo classico, determinando ad esempio il raggio e la velocità angolare dell'orbita corrispondente ad ogni stato energetico dello spettro. Anche queste osservabili fisiche, come accade per l'energia, non possono subire variazioni arbitrariamente piccole, potendo assumere solo determinati valori.
Tornando alla domanda dl web-nauta, possiamo ad esempio calcolare la velocità nel nel modello di Bohr dell’atomo di idrogeno, assumendo che questo si trovi nel primo livello. In questo caso l’elettrone è costretto in un’orbita di raggio r= 0.529 Angstrom, la velocità è
\[v=\frac{n~h}{2π~r~m}\]
dove h è la costante di Planck, n è il numero del livello energetico (1 in questo caso), ed m la massa dell’elettrone. Sostituendo i valori ottieni che v è 2.18 x 106 ms-1. Ricordiamo che si tratta di una stima della velocità dell’elettrone e che i due osservabili (posizione e velocità) non possono essere noti simultaneamente poichè vale il principio di indeterminazione di Heisenberg: DpDr≥ℎ/4p , dove p è l’impulso della particella.
Stefano Bellucci - Fisico
[modificato da G. Chiarelli marzo 2020]

