Se la luce non fosse quantizzata, accendere una lampadina sarebbe un problema?

Caro lettore,
la quantità di energia che ogni corpo irradia (e assorbe), dipende soltanto dalla sua temperatura, sia che si tratti di una lampadina, di un forno o di una stella. Un caso interessante è quello del cosiddetto "corpo nero" ovvero un oggetto che assorbe e riemette tutta l'energia che riceve.
La questione dello spettro di emissione di un corpo nero fece impazzire i fisici per tutta la seconda metà dell'800 fino a quando Max Planck, nel 1900, trovò la soluzione.
Fino ad allora esistevano leggi empiriche che descrivevano le caratteristiche della sua emissione in funzione della temperatura e della lunghezza d'onda della radiazione ma non esiteva una teoria che spiegasse il perchè delle osservazioni sperimentali.
Planck studiò il problema dal punto di vista della meccanica statistica sviluppata da Boltzmann, supponendo che la radiazione venisse emessa da oscillatori armonici di tutte le frequenze possibili ma non in modo continuo, bensì a multipli interi di una quantità minima che dipende dalla frequenza dell'oscillatore attraverso una costante, che oggi è conosciuta come costante di Planck.
Inizialmente, Planck considerò questa trattazione come un disperato trucco matematico, ma in seguito, grazie anche alla spiegazione dell'effetto fotoelettrico da parte di Einstein, la quantizzazione dell'energia si dimostrò una teoria valida a spiegare il comportamento dell'infinitamente piccolo.
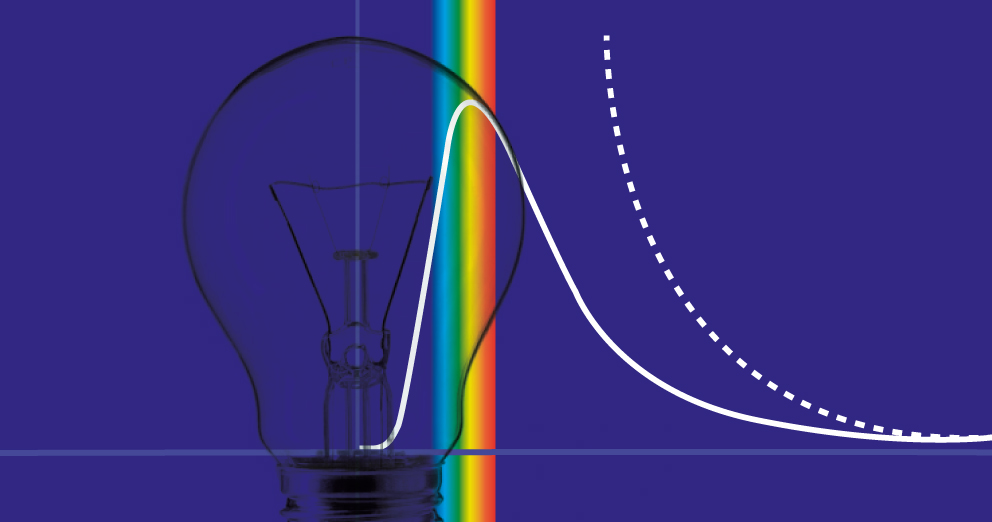
Ma che cosa succede se si elimina l'ipotesi dello scambio quantizzato dell'energia? Sempre nel 1900 Lord Raleigh affrontò lo stesso problema utilizzando anch'egli la meccanica statistica e il teorema di equipartizione dell'energia, il quale afferma che tutte le particelle di un grande insieme, in questo caso gli infiniti oscillatori armonici, possono assumere tutti i valori possibili di energia con una data distribuzione di probabilità la cui media è proporzionale alla temperatura di equilibrio. Questa assunzione riproduce in maniera soddisfacente l'andamento dell'emissione di energia a basse frequenze ma diverge rapidamente per le alte frequenze, tanto da arrivare ad una irrealistica emissione infinita di energia nella regione dell'ultravioletto, dando luogo a quella che Paul Ehrenfest definì la "catastrofe ultravioletta".
Per tornare, quindi, alla tua domanda e alla nostra lampadina (o alla nostra stella) è come se tutta l'emissione di energia fosse assurdamente schiacciata in una regione dello spettro elettromagnetico che i nostri occhi non percepiscono come colore. Il problema, tuttavia, non esiste nella realtà ma solo nella interpretazione delle osservazioni sperimentali, che sono il fondamento della fisica e della scienza in generale.
L'errore, nell'approccio di Raleigh viene di norma imputato alla non applicabilità della meccanica classica di per sè, ma recentemente è stato messo in evidenza che l'errore possa piuttosto originarsi dall'effettiva applicabilità del principio di equipartizione dell'energia, che non sarebbe lecito per un sistema infinito, come è quello degli oscillatori responsabili dell'emissione della radiazione.
L'applicabilità di tale principio in un sistema a infiniti gradi di libertà è l'argomento di un interessante articolo scientifico.
Commentando i risultati della loro pubblicazione i ricercatori affermano: "Nel nostro lavoro mostriamo che una trattazione corretta delle equazioni classiche non porta ad alcun risultato assurdo ed in particolare non porta alla legge di Rayleigh-Jeans. Al contrario è compatibile con la legge di Stefan- Boltzmann, che è nota essere in pieno accordo con i risultati sperimentali.
I nostri risultati richiedono pertanto una riconsiderazione critica del ruolo della fisica classica per la comprensione della meccanica quantistica.
Marco Cinausero, fisico
ultimo aggiornamento maggio 2024