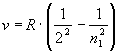|
Approfondimento a cura di Gaetano Mauro Briganti La storia incomincia lontano nel tempo, circa nella seconda metà del XVII sec. con la scoperta di Newton dello spettro solare. Avvenne per caso , quando Newton si fermò ad osservare il figlioletto mentre giocava con le bolle di sapone accanto alla madre; si accorse subito degli effetti interferenziali prodotti dalla sottile pellicola delle bolle sulla superficie esterna e ideò un esperimento.Fece passare un sottile raggio di luce bianca solare, proveniente da una minuscola fessura, attraverso una parete laterale di un prisma di cristallo di vetro e rimase affascinato dal fenomeno della dispersione della luce bianca nei vari colori fondamentali che si erano formati su una parete bianca leggermente spostata rispetto al prisma: aveva riprodotto i colori dell’arcobaleno. Dopo questa scoperta , quasi duecento anni dopo, si sviluppò un importantissimo campo di ricerche: la spettroscopia, che studia lo spettro della luce emessa e assorbita da atomi e da molecole in relazione alle condizioni chimico-fisiche della sorgente luminosa o delle sostanze gassose attraversate dalla luce. Nella seconda metà dell’800, ad opera dello sviluppo di uno strumento meraviglioso chiamato spettroscopio , questa ricerca divenne il mezzo più potente per lo studio della struttura degli atomi. Se si pone davanti alla fenditura dello spettroscopio una sostanza gassosa portata ad alta temperatura, si osserva lo spettro di emissione caratteristico di quella sostanza: uno spettro di righe, per gli atomi, o di bande, per le molecole, ma non uno spettro continuo come ci si aspettava e come avveniva per altre sorgenti. Apparivano soltanto righe, di diverso colore, brillanti e parallele alla fenditura dello strumento. Per una specie gassosa monoatomica le righe sono relativamente distanziate le une dalle altre presentando alcuni addensamenti che sembrano del tutto casuali. Le ricerche fondamentali in questo campo furono pubblicate dai tedeschi Kirchhoff e Bunsen intorno al 1860. Oltre allo spettro di emissione, Kirchhoff interpretò e provò sperimentalmente anche gli spettri di assorbimento a righe oscure scoperte dal fisico e costruttore di strumenti scientifici, anch’egli tedesco, Joseph von Fraunhofer nel 1815. Kirchhoff, oltre a stabilire che lo spettro della luce emessa da un vapore monoatomico è uno spettro di righe caratteristico dell’elemento che costituisce il vapore, enunciò, quindi, anche la legge della inversione, cioè che le radiazioni elettromagnetiche che una sostanza emette sono anche quelle che essa può assorbire: anche lo spettro di assorbimento è, dunque, caratteristico dell’elemento studiato così come quello di emissione. Si aprì, in tal modo, la strada alla conoscenza degli elementi contenuti nell’atmosfera incandescente delle stelle ripetendo, a livello ottico, la meravigliosa sintesi della meccanica di Newton. L’astrofisica moderna inizia, infatti, proprio con le scoperte di Kirchhoff. Uno spettro di righe dà, a prima vista, un’impressione di completo disordine: invece esso nasconde regolarità e leggi affascinanti che, come è stato scritto, sono “ di così rara bellezza, eleganza e perfezione quali non si incontrano in alcuna parte della Fisica”. Fu proprio l’interpretazione di questa complicata struttura di spettri a righe che ha portato alle moderne teorie sulla struttura dell’atomo e sulla natura della radiazione elettromagnetica. Per non occupare troppo spazio nel sito, per il desiderio di raccontare tutto, torniamo subito allo spettro a righe ottenuto dall’eccitazione degli atomi d’idrogeno ; come si è detto o si è pensato ma non detto, ogni elemento chimico, con l’aiuto di un’opportuna eccitazione ( fiamma, arco, scintilla, scarica elettrica o semplice collisione tra gli atomi di un gas), dà origine ad uno spettro a righe caratteristico dell’elemento. Ora, nel 1987, con la scoperta dell’elettrone da parte di J.J.Thomson ( misura del rapporto e/m con un tubo a vuoto e la compensazione della forza elettrica e di quella di Lorentz comunicata durante una riunione della Royal Institution il 30 Aprile 1897), si comprese: 1) che gli atomi, essendo neutri, devono portare una carica positiva ed una negativa di pari valore, 2) che, in seguito ad altre misure di e/m ( e = carica dell’elettrone,m = massa dell’elettrone) di J.J. Thomson, lo ione idrogeno aveva una massa superiore a più di 1000 volte quella dell’elettrone. Quindi lo stesso J.J. Thomson ipotizzò un modello atomico, chiamato “modello panettone”,ove l’atomo era costituito da una grande( relativamente ad e) massa carica positivamente con gli elettroni incastonati in questa massa come l’uvetta nel panettone.Dopo l’esperimento di Geiger e Mardsen del 1911, si scoprì, con l’interpretazione di Rutherford dei dati sperimentali raccolti dai suoi allievi, che l’atomo doveva avere un nucleo centrale densamente massivo e carico positivamente ed elettroni periferici portatori della carica negativa e con massa 1836 volte più piccola del nucleo dell’idrogeno che ruotavano con una danza velocissima intorno al nucleo : si era così costruito il “modello planetario”. A questo punto finisco la descrizione preliminare, necessaria a comprendere la grande scoperta fatta nel 1885 da J. J. Balmer. Egli era un professore di scienze in una scuola secondaria superiore femminile svizzera che occupava il suo tempo libero, da fisico, studiando e cercando, provando e riprovando modelli matematici capaci di raccogliere e quindi spiegare i dati spettroscopici sperimentali con una semplice formula matematica. Egli osservò le quattro nette righe nel visibile dello spettro di assorbimento del Sole e, presto, sulla base degli studi precedenti di Kirchhoff, le identificò come appartenenti allo spettro dell’atomo d’idrogeno. Queste righe, oggi, sono chiamate righe della “serie di Balmer ”in suo onore per averle identificate e per averne trovato la legge descrittiva. Sono righe nel visibile, la cui lunghezza d’onda, , è riportata in parentesi subito dopo la sigla identificativa della riga; l’unità di misura della lunghezza d’onda è quella usata in Fisica atomica: l’angstrom, dove 1 Å = 10 m. Le rihe sono: Hα ( 6562,8 Å ), Hβ ( 4861,3 Å), Hγ ( 4340,5 Å), Hδ (4101,7 Å ). Sono tre righe nel visibile e una nel vicino ultravioletto corrispondenti ad un rosso,un verde,un indaco e un violetto. Si chiama “ serie di Balmer “ perché le righe con il diminuire della lunghezza d’onda ,? , si infittiscono fino a diventare un continuo non risolubile. Balmer trovò che le lunghezze d’onda delle righe potevano essere rappresentate in modo accurato con la formula
Considerando che la frequenza, γ, di un’onda elettromagnetica è legata alla sua lunghezza d’onda dalla semplice formula , con c = velocità della luce nel vuoto, oggi la formula di Balmer viene scritta in forma più esplicativa :
dove R è la costante di Rydberg il cui valore è R = 109677,576 cm-1 ( 13,597 eV). Nonostante la semplicità della formula, si ottiene un accordo notevole tra i valori teorici calcolati e i valori sperimentali: accordo di 1 a 107 che è il limite di precisione spettroscopica. Quando il numero 2 della formula di Balmer viene sostituito con n2 = 1 e a n1 si danno i valori 2,3,…,si ottengono le righe di Lyman nell’ultravioletto estremo; con n2 = 3 e n1 = 4,5,…,la serie di Paschen nell’infrarosso; con n2 = 4 e n1 = 5,6,…,la serie di Brackett nell’infrarosso; con n2 = 5 la serie di Pfund anch’essa nell’infrarosso. Per completare la storia almeno con una prima approssimazione, basta solo ricordare che l’interpretazione di questi dati spettroscopici con una teoria dell’atomo d’idrogeno si deve al lavoro del fisico danese Niels Bhor del 1913. |