 Il percorso “La nucleosintesi degli elementi” ci pone l’interrogativo sull’origine degli elementi. Ne conosciamo tanti, per esempio l’azoto e l’ossigeno che respiriamo o il carbonio su cui si basa il ciclo della vita, o ancora il ferro presente nei globuli rossi del sangue, ma pochi ne conoscono l’origine. Il percorso illustra i meccanismi di produzione degli elementi, ovvero la nucleosintesi, partendo da un’introduzione storica sulla tavola periodica di Mendeleev che risale al 1869 e ci guida poi attraverso i fenomeni stellari responsabili di questa produzione, dall’idrogeno fino all’uranio.
Il percorso “La nucleosintesi degli elementi” ci pone l’interrogativo sull’origine degli elementi. Ne conosciamo tanti, per esempio l’azoto e l’ossigeno che respiriamo o il carbonio su cui si basa il ciclo della vita, o ancora il ferro presente nei globuli rossi del sangue, ma pochi ne conoscono l’origine. Il percorso illustra i meccanismi di produzione degli elementi, ovvero la nucleosintesi, partendo da un’introduzione storica sulla tavola periodica di Mendeleev che risale al 1869 e ci guida poi attraverso i fenomeni stellari responsabili di questa produzione, dall’idrogeno fino all’uranio.
di Gruppi Italiani Astrofisica Nucleare Teorica e Sperimentale
L'UNESCO ha dichiarato il 2019 "Anno Internazionale della Tavola Periodica". Si celebrano infatti i 150 anni dalla pubblicazione della Tavola degli Elementi da parte del chimico russo Dmitrij Mendeleev. Il 6 marzo 1869 presentò formalmente alla Società Russa di Chimica la sua classificazione degli elementi chimici, che intitolò: "La dipendenza tra le proprietà dei Pesi Atomici degli Elementi".
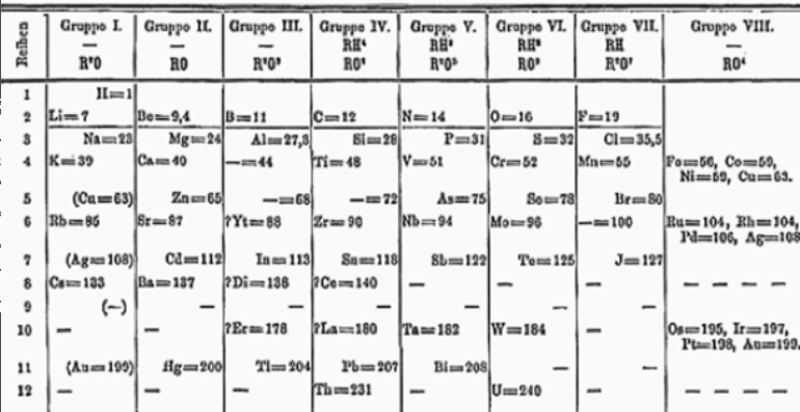
Immagine estratta da http://www.oa-abruzzo.inaf.it/CRISTALLO/periodictable2019_ita.html
Mendeleev non fu l’unico né il primo a proporre una classificazione degli elementi chimici. Negli stessi anni erano già apparsi diversi tentativi di ordinare gli elementi sulla base di proprietá chimiche. Mendeleev ebbe l’intuizione di lasciare vacanti alcune caselle della tavola, ipotizzando l'esistenza degli elementi mancanti perché ancora sconosciuti. Propose anche il nome per gli elementi ignoti: eka-silicio, eka-alluminio ed eka-boro, per rimarcare la loro posizione nella tabella sotto gli elementi già noti al tempo. Oggi questi elementi sono denominati germanio, gallio e scandio.
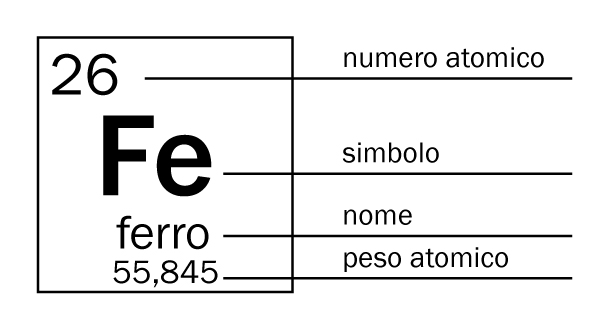 All'epoca di Mendeleev erano noti circa 60 elementi chimici, ma oggi ne conosciamo più del doppio. Gli ultimi 4 elementi scoperti in ordine cronologico risalgono al 2016 e hanno i nomi di nihonio, moscovio, tennessinio e oganessio. Nella Tavola Periodica, gli elementi sono ordinati in base a proprietà chimiche, cioè per numero atomico crescente (indicato con il simbolo Z), ossia in base al numero crescente di protoni all’interno dei vari nuclei atomici. Gli atomi risultano globalmente neutri, perché intorno ai nuclei (carichi positivamente) orbitano gli elettroni, che possiedono una carica elettrica negativa. All’interno dei nuclei sono presenti anche i neutroni, ossia particelle elettricamente neutre con massa simile a quella dei protoni. Un atomo è dunque costituito da un nucleo (contenente protoni e neutroni), immerso in una “nuvola” di elettroni. La carica di un nucleo è indicata dal numero atomico (Z); la sua massa è invece solitamente rappresentata dalla somma dei suoi nucleoni (A, definito come la somma dei protoni e dei neutroni) poiché la massa degli elettroni è trascurabile rispetto a quella dei nuclei.
All'epoca di Mendeleev erano noti circa 60 elementi chimici, ma oggi ne conosciamo più del doppio. Gli ultimi 4 elementi scoperti in ordine cronologico risalgono al 2016 e hanno i nomi di nihonio, moscovio, tennessinio e oganessio. Nella Tavola Periodica, gli elementi sono ordinati in base a proprietà chimiche, cioè per numero atomico crescente (indicato con il simbolo Z), ossia in base al numero crescente di protoni all’interno dei vari nuclei atomici. Gli atomi risultano globalmente neutri, perché intorno ai nuclei (carichi positivamente) orbitano gli elettroni, che possiedono una carica elettrica negativa. All’interno dei nuclei sono presenti anche i neutroni, ossia particelle elettricamente neutre con massa simile a quella dei protoni. Un atomo è dunque costituito da un nucleo (contenente protoni e neutroni), immerso in una “nuvola” di elettroni. La carica di un nucleo è indicata dal numero atomico (Z); la sua massa è invece solitamente rappresentata dalla somma dei suoi nucleoni (A, definito come la somma dei protoni e dei neutroni) poiché la massa degli elettroni è trascurabile rispetto a quella dei nuclei.
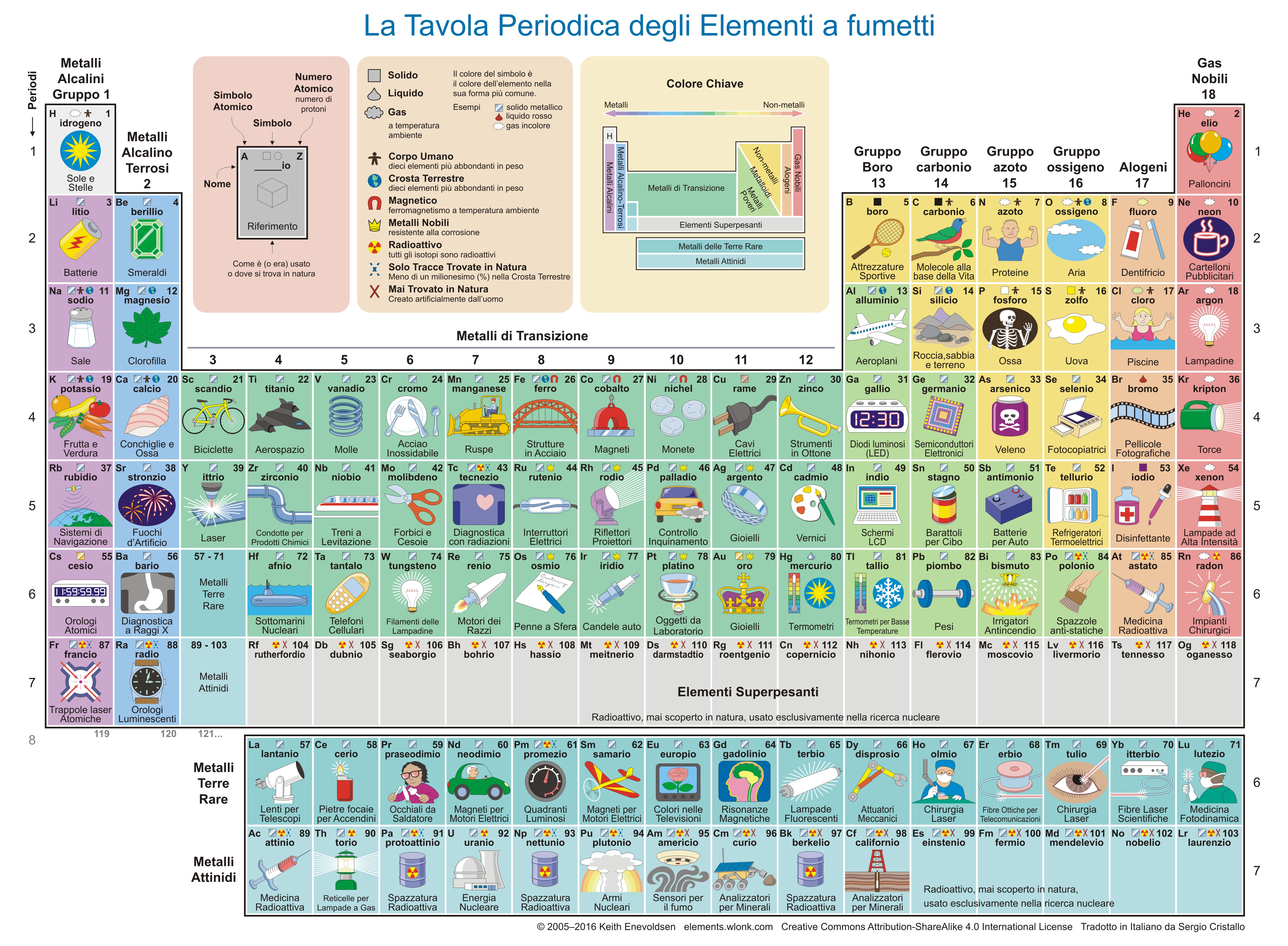 Immagine estratta da http://www.oa-abruzzo.inaf.it/CRISTALLO/periodictable2019_ita.html
Immagine estratta da http://www.oa-abruzzo.inaf.it/CRISTALLO/periodictable2019_ita.html
Ogni elemento chimico ha una sua caratteristica composizione isotopica. Gli isotopi sono atomi che hanno lo stesso numero atomico, ma un numero diverso di neutroni. Esistono elementi che hanno un singolo isotopo stabile (come il fluoro o l’oro), elementi con molti isotopi stabili (lo stagno, è quello che ne ha di più: ben 10!) ed elementi senza alcun isotopo stabile (come il tecnezio).

