di Gruppi Italiani Astrofisica Nucleare Teorica e Sperimentale
Una delle domande che si sono posti i fisici e gli astrofisici fin dai primi tentativi di classificazione degli elementi gira attorno al loro meccanismo di produzione: come si sono formati tutti gli elementi chimici che conosciamo?
L’ipotesi più plausibile è che a partire dai costituenti primi, cioè i protoni e i neutroni, gli elementi più pesanti si siano formati tramite reazioni nucleari. La questione quindi si sposta sul come sia possibile innescare queste reazioni nucleari, visto che i nuclei si respingono in virtù della carica elettrica. In particolare, se per fondere due nuclei è necessario vincere la forza di repulsione di natura elettrica, nota come barriera di Coulomb, servono condizioni termodinamiche particolari. Per esempio a temperature dell’ordine di alcuni milioni di gradi, l’agitazione termica fornisce ai nuclei una velocità tale da permettere ai nuclei di avvicinarsi molto e innescare le reazioni nucleari di fusione.
Sappiamo che sulla Terra non esistono condizioni fisiche naturali per creare alcun nuovo elemento, a parte pochissime eccezioni, perché non vi sono temperature sufficientemente alte. Di conseguenza, gli elementi che osserviamo sulla Terra erano già presenti al momento della sua formazione (nonché del Sole, visto che il nostro pianeta è costituito dello stesso materiale da cui si è formata la nostra stella). Vale la pena quindi introdurre un concetto che risulterà più chiaro in seguito: la durata della vita di una stella dipende dalla sua massa e, per le conoscenze che abbiamo oggi sull’evoluzione stellare, sappiamo che la prima popolazione di stelle, quelle formatesi dopo il Big Bang, ha già terminato la propria vita e ha immesso nel mezzo interstellare nuclei sintetizzati al suo interno. Le stelle di generazioni successive, come il Sole, sono nate delle ceneri delle stelle precedenti e dunque ereditano i frutti della nucleosintesi delle generazioni di stelle precedenti. Se consideriamo il Sole come riferimento per capire quali sono gli elementi più abbondanti nell’Universo, vediamo che i due elementi più leggeri (idrogeno H ed elio He) rappresentano circa il 98% della sua massa (H per circa il 70%, He per il restante 28%).
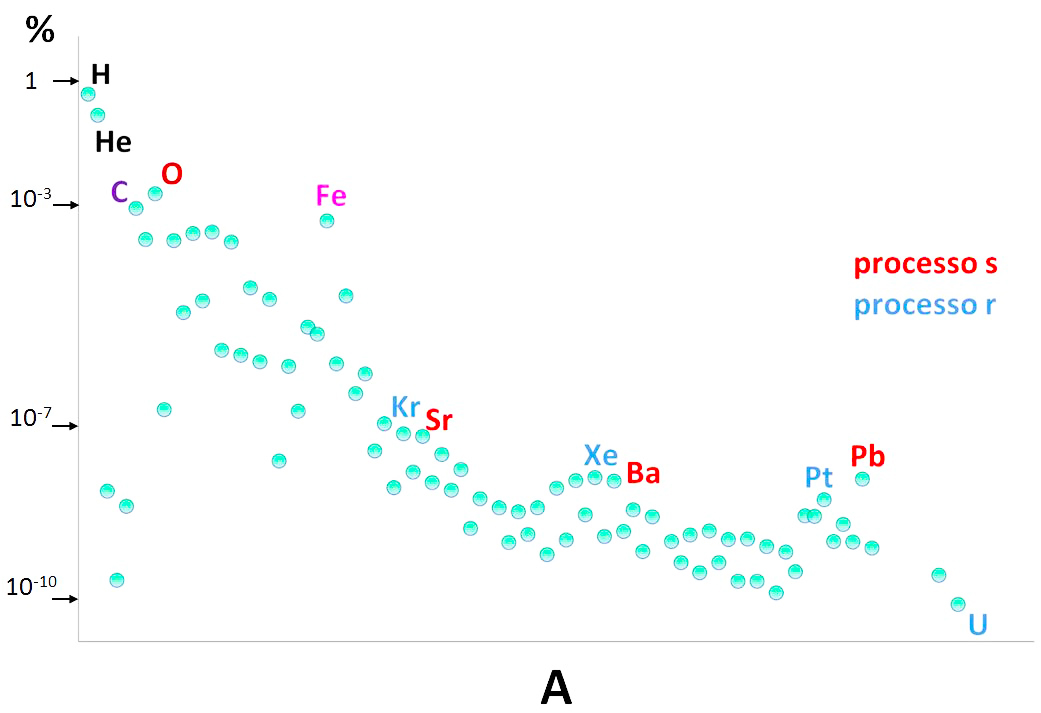
Immagine estratta da http://www.oa-abruzzo.inaf.it/CRISTALLO/periodictable2019_ita.html
Nella figura sono riportate le abbondanze chimiche osservate sulla superficie del Sole (o misurate da altre sorgenti quando l'elemento non è direttamente misurabile). Una cosa importante da notare è la scala delle ordinate, che è logaritmica: ogni tacca in più indica una quantità 10 volte maggiore. La scala logaritmica, non solo permette di visualizzare in una singola figura tutte le abbondanze, ma ci fa notare anche che le abbondanze variano di ben 10 ordini di grandezza, 10 elevato alla 10. Questo vuol dire che l'idrogeno è 10 miliardi di volte più abbondante dell’uranio!

