di Patrizia De Simone
Per più di duemila anni l'idea di Aristotele ebbe la meglio; ma a partire dal XVIII secolo gli scienziati, con una serie di scoperte che hanno dato origine alla chimica moderna, hanno dimostrato che tutte le sostanze sono scomponibili in piccolissimi costituenti corpuscolari, troppo piccoli per essere osservati con le tecniche dell'epoca. Seguendo la tradizione dei filosofi greci, i chimici chiamarono atomi ![]() tali costituenti.
tali costituenti.
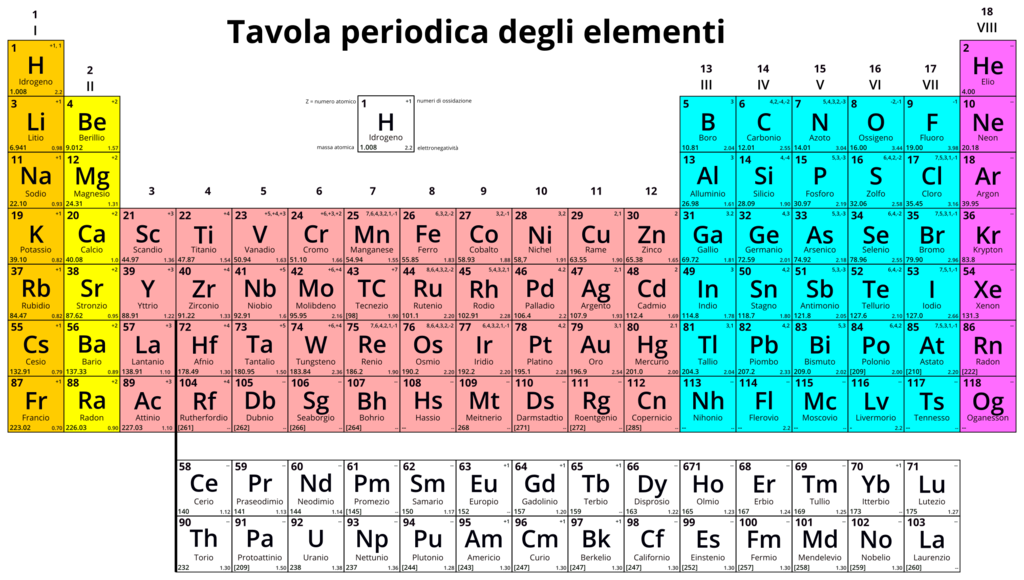
Questa denominazione ebbe successo: i vari elementi chimici vennero catalogati in gruppi che mostravano proprietà simili, e da questo procedimento derivò la Tavola Periodica degli Elementi![]() .
.
 In seguito, i fisici dimostrarono che gli atomi identificati dai chimici erano divisibili. Nelle decadi tra Ottocento e Novecento molti brillanti esperimenti mostrarono che gli atomi sono composti da un piccolo e denso nucleo
In seguito, i fisici dimostrarono che gli atomi identificati dai chimici erano divisibili. Nelle decadi tra Ottocento e Novecento molti brillanti esperimenti mostrarono che gli atomi sono composti da un piccolo e denso nucleo ![]() centrale di carica
centrale di carica ![]() positiva intorno al quale sono in costante moto particelle di carica elettrica negativa, chiamati elettroni
positiva intorno al quale sono in costante moto particelle di carica elettrica negativa, chiamati elettroni ![]() .
.
Nuclei ed elettroni si combinano in vari modi, tali da determinare le diverse proprietà chimiche osservate.
Per un certo tempo, i fisici pensarono che gli elettroni e il nucleo fossero gli atomi dei greci, le particelle elementari di cui tutta la materia è composta. Avevano solo parzialmente ragione; infatti, mentre l'elettrone è ancora oggi ritenuto indivisibile, nuovi esperimenti rivelarono che il nucleo atomico non è una particella fondamentale.

