percorso di Silvia Miozzi
Fasci di particelle per il trattamento dei tumori
Per quanto l’esplorazione dell’utilizzo delle radiazioni per la cura di tumori abbia oltre un secolo di vita, è solo a partire dagli anni ’50 del novecento (dopo alcuni decenni di sviluppo di tecnologie e delle conoscenze mediche necessarie), che il loro utilizzo nella cura del cancro entra a far parte del bagaglio a disposizione dei medici.
Al suo inizio la radioterapia, anche detta teleterapia, ossia la tecnica che impiega fasci di radiazioni esterni diretti verso l’interno del corpo, sfrutta sorgenti di cobalto 60. Quando le cellule tumorali vengono colpite, il DNA dei loro nuclei viene profondamente danneggiato. Le cellule muoiono e il sistema immunitario le elimina.
Negli stessi anni con la costruzione dei primi acceleratori di particelle si pensò di sfruttare i fasci prodotti, per impiegarli anche nella teleterapia modificando gli apparati costruiti per la ricerca in impianti sanitari. Nel 1960 fu costruito il primo LINAC dedicato alla teleterapia, un apparato che poteva ruotare attorno al paziente.
Con il progresso nella scienza degli acceleratori e delle nuove tecniche per il trattamento dei tumori, negli ultimi decenni sono stati fatti importanti passi verso la cura di queste malattie.
La forma più comune di radioterapia sfrutta raggi X di alta energia prodotti dall’urto di elettroni accelerati su un bersaglio di tungsteno. Con questa tecnica però non si può evitare di colpire, e inevitabilmente danneggiare, anche i tessuti sani che il fascio di raggi X attraversa prima di raggiungere il tumore. Questo inevitabile danno collaterale, è tanto più importante quanto questo ha colpito un organo interno.
L’obiettivo di molte nuove tecniche consiste nel fornire un’alta dose di radiazione per distruggere i tessuti malati e contemporaneamente preservare i tessuti sani.
Per tumori superficiali, come quelli della pelle, vengono utilizzati direttamente fasci di elettroni che perdono energia rapidamente quando interagiscono con gli atomi del corpo. Fermandosi sugli strati superficiali provocano molti meno danni rispetto ai raggi X.
Per il trattamento di tumori profondi oppure che si trovano in zone particolarmente ricche di nervi e vasi importanti (base del cranio, l’occhio) oppure inoperabili perché situati zone inaccessibili, la tecnica più efficace è l’adroterapia.
Il caso dell’adroterapia è particolarmente interessante per capire come la cosiddetta ricerca di base, possa produrre effetti importanti a distanza di decenni.
Il primo ad intuirne le possibilità, ed a proporre l’uso di particelle pesanti (protoni, ioni carbonio etc) fu R.R. Wilson nel 1946. Lo studio dell’interazione tra queste particelle e la materia aveva evidenziato come la loro perdita di energia è concentrata in pochi mm e non avviene in maniera continua, a differenza degli elettroni. Ad esempio un protone di 25 MeV, attraversando l’acqua, perde la maggior parte della sua energia in un picco a 6 cm. Wilson intuì che questa proprietà poteva essere sfruttata per colpire le cellule tumorali posizionate al picco, senza danneggiare i tessuti sani. I primi studi furono svolti a partire dalla metà degli anni ’50 utilizzando gli acceleratori di ricerca disponibili nei laboratori di fisica. Si allestivano apposite sale per il trattamento dei pazienti, migliorando la comprensione dei processi biologici in atto. Per arrivare ad un utilizzo clinico di routine dobbiamo arrivare al 1990 quando entrarono in funzioni i primi centri (a Loma Linda, California e Clatterbrigde UK), dove i pazienti venivano curati utilizzando il fascio di un sincrotrone costruito appositamente.
Le particelle che vengono utilizzate nell’adroterapia sono protoni, neutroni oppure ioni (carbonio, elio). I tre tipi di particella rilasciano energia in modo differente quando penetrano nei tessuti e il loro impiego è funzione del tipo di cancro che deve essere curato.
Il grande vantaggio dell’adroterapia è che il meccanismo di morte cellulare è estremamente preciso venendo colpita quasi esclusivamente la massa tumorale e preservando i tessuti sani.
Tale fenomeno è reso possibile dalla modalità di rilascio dell’energia durante il trattamento: quando il fascio di particelle accelerato raggiunge il corpo del paziente, è talmente veloce che non riesce ad interagire con i tessuti che attraversa e quindi non li danneggia. Mano a mano che penetra e procede verso il bersaglio, però, il fascio subisce un progressivo rallentamento pur rimanendo collimato, fino ad arrivare ad un punto in cui si arresta, il cosiddetto “Picco di Bragg”.
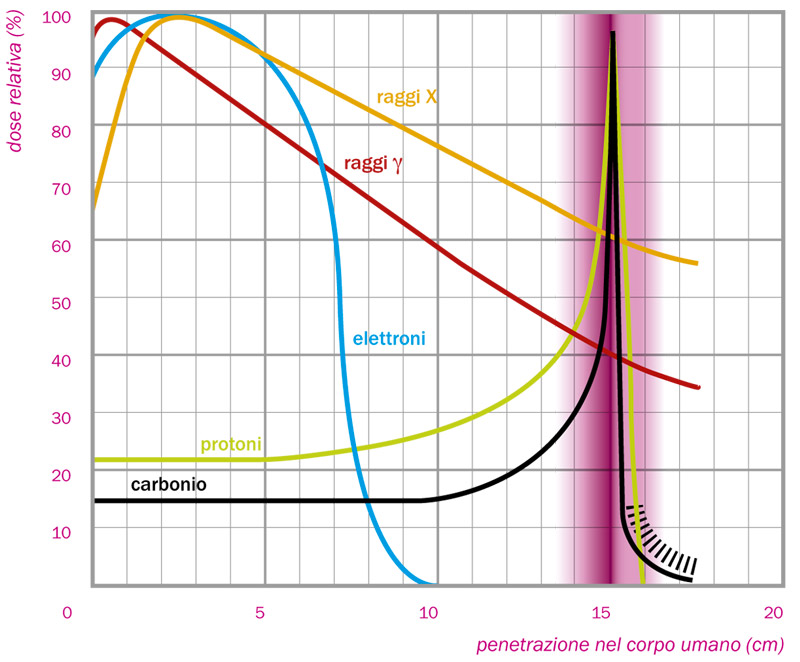
La figura mostra la dipendenza dalla profondità della dose relativa depositata per diverse radiazioni. La distribuzione di dose dei protoni e del carbonio ha un andamento diverso rispetto a quello di un fascio di elettroni di alta energia. Per protoni e carbonio, la dose in superficie è bassa rispetto a quella assorbita nella regione del picco, al contrario di quanto accade per elettroni, raggi X e gamma. Nel caso del carbonio, è evidenziata la regione interessata dagli effetti della frammentazione. (F. Cuicchio Asimmetrie INFN)
Questa caratteristica implica che il controllo del fascio utilizzato, e la conoscenza di come questo interagisca con i tessuti del corpo umano, debba essere estremamente dettagliata. Anche un piccolo sbaglio potrebbe danneggiare seriamente i tessuti sani. È questo il motivo principale per cui ci sono voluti oltre quaranta anni per poter curare il primo paziente.
In Italia il primo centro per adroterapia (utilizzando un fascio di protoni) è entrato in funzione nel 2002 presso i Laboratori Nazionali del Sud dell’INFN a Catania in collaborazione con l’Ospedale Cannizzaro (da allora sono stati curati oltre 400 pazienti).

La sala di trattamento di Catana, nei Laboratori del Sud dell’Infn a Catania.
Più recentemente sono entrati in funzione due centri dedicati. Uno, nel 2014, a Trento (utilizzando un fascio di protoni), ed uno nel 2012, a Pavia. Si tratta del CNAO dove fasci di protoni o ioni carbonio vengono pre accelerati in un LINAC e poi iniettati in un sincrotrone di 25 m di diametro dove raggiungono le energie di 250 MeV i protoni e 4800 MeV gli ioni. Alla costruzione di entrambi questi acceleratori hanno dato il loro contributo i fisici dell’INFN e, nel caso del CNAO, anche del CERN. Centri che, come il CNAO possono utilizzare i fasci di ioni per la terapia, esistono solo in Germania, Cina, Giappone e, dall’anno scorso in Austria. I centri dedicati solo alla terapia con protoni (LNS e Trento) utilizzano un ciclotrone, mentre il CNAO utilizza un sincrotrone.

Sincrotrone del CNAO
Produzione di radiofarmaci
Gli acceleratori sono largamente usati anche per la produzione di radiofarmaci che possono essere impiegati in medicina sia per la cura di particolari tumori sia per l‘imaging medico, ossia la produzione di immagini per la diagnostica. La produzione avviene accelerando protoni o ioni che, inviati su un bersaglio, producono isotopi radioattivi i quali tramite un processo chimico vengono inclusi in molecole attive a livello metabolico. Tali molecole possono essere introdotte nel corpo umano tramite inalazione, per via orale oppure endovenosa. In maniera molto schematica, una volta all’interno del corpo umano queste molecole si addensano nei tessuti per i quali sono state ideate (ad esempio per raccogliersi nei tessuti tumorali). Qui gli isotopi decadono e questi prodotti sono identificati da rivelatori di radiazione costruiti con specifiche di precisione adeguate che permettono la ricostruzione spaziale del tessuto tumorale. In questo modo i medici possono ottenere un’immagine in tempo reale.
Nella sezione dedicata ai rivelatori verranno spiegate le tecniche di rivelazione della radiazione emessa.

Presso i Laboratori Nazionali di Legnaro dell’INFN è nato il progetto
SPES-gamma per la produzione di radionuclidi di interesse medicale utilizzando il ciclotrone SPES-alfa. L'obiettivo è la produzione di radiofarmaci innovativi.

